Geceleri uyuyamıyor musunuz? Diyabet şikayetiniz mi var? Peki neden yaşlandıkça uyku problemleri ve şikayetler artıyor? Bu sorunların sirkadyen ritim denilen günlük vücut ritminizden kaynaklandığını hiç düşündünüz mü? Bakın Doç. Dr. Satchin Panda ne diyor? “Geceleri saatimize yavaşlamasını söyleyen mekanizmayı kabaca biliyorduk, fakat sabahları bizi tekrar neyin aktifleştirdiğini bilmiyorduk. Onu henüz keşfettik, artık biyolojik saatin işlev bozukluklarının (malfunction) bizi nasıl yaşlandırdığını ve kronik hastalıklar geliştirdiğini daha derin bir şekilde araştırabiliriz”.
Makaleyi sesli dinle (Play tuşuna basın ve bir kaç saniye bekleyin):
[haiku url=”https://www.tamsat.org.tr/tr/ses/sirkadyen_ritm_nedir.mp3″ defaultpath=disabled]
İsterseniz sirkadyen ritminizin nasıl çalıştığına ve vücudunuzu nasıl etkilediğine, neden uyku problemleri yaşadığınıza, her sabah nasıl oluyor da aynı saatte çalar saat olmasa bile gözünüzü açabildiğinize, diyabet rahatsızlığında günün belli saatlerinde meydana gelen şeker-yağ dönüşümünden neyin sorumlu olduğuna, kanserde hücrelerin nasıl gelişeceğini ve bölüneceğini kontrol edenin ne olduğuna birlikte bakalım.
Biyolojik Saatin Düzenlenmesi:
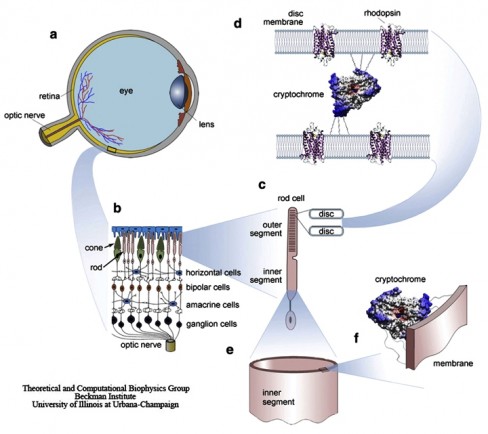
Gündelik ritim (circadian rhythm) organizmaların fizyoloji ve davranışlarında 24 saatlik dönem içinde tekrarlayan dalgalanmaları ifade etmektedir. Bu ritmi ayarlayan saate gündelik saat (circadian clock) adı verilmektedir. Gündelik saatin düzenli olarak güneş saatine göre ayarlanması gerekmektedir. Prof.Dr. Aziz Sancar, bakterilerde DNA tamir eden fotoliyaz enziminin benzeri olan bir proteinin insan hücrelerinde tamir yapamadığını saptadıktan sonra, bu proteinin memeli hayvanlarda biyolojik saatin düzenlenmesinde yer alabileceği hipotezini geliştirmiş, gerçekten de memeli hayvanların kriptokrom adını verdiği bir proteini kullanarak gündelik saati ayarladıklarını göstermiştir. Prof. Dr. Aziz Sancar’ın çalışmakta olduğu “biyolojik saat” ve “circadian rhythm” son derece güncel ve önemli gelişmeler içinde olan bilimsel araştırma alanlarıdır.
Prof. Dr. Aziz Sancar ve araştırma ekibi bitkilerdeki fotoliyaz enzimine şaşırtıcı bir biçimde benzeyen 2 kriptokrom proteini tanımlamıştır. Bu proteinler de tıpkı fotoliyazın bitkilerde yaptığı gibi biyolojik saati insan ve diğer memelilerde kontrol etmektedirler.
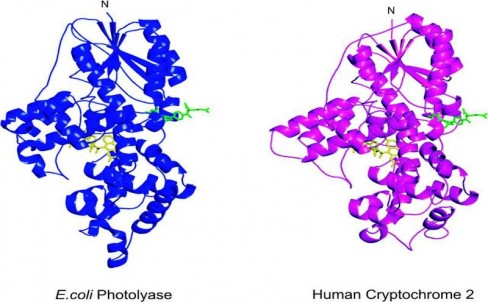
Resim-1. Fotoliyaz ve insan kriptokromunun yapısal benzerliği. C terminalindeki 106 aminoasit gösterilmemiştir. Sarıyla gösterilenler FAD; yeşille gösterilenler MTHF’dir.
Fotoliyaz, UV ile hasara uğramış DNA’yı reaksiyonu başlatmak için enerji kaynağı olarak mavi/mor ışık (350-500 nm) kullanarak onarmaktadır.
Bazı fotoliyazlara %50’ye varan sekans benzerliği gösteren kriptokrom, bitkilerde büyüme ve gelişmeyi içeren bazı mavi ışık cevaplarını ve hayvanlardaki ışık-bağımlı ve ışık-bağımsız mekanizmalar ile sirkadyen ritmi düzenler.
Sirkadyen ritim, organizmaların 1 günlük periyodu (circa = about, dies = day) ile ilgili biyokimyasal, fizyolojik ve davranışsal fonksiyonlarındaki osilasyondur.
Kriptokromlar
125 yılı aşkın bir süredir, bitkilerde fototropizma, fotoperiyodizm (gün uzunluğunun ölçümü), büyüme ve gelişmeyi içeren birkaç cevap sergileyenin mavi ışık olduğu biliniyor. Mavi ışık reseptörünün yapısı uzun bir süredir sır olarak kaldı ve “kriptokrom” terimi mavi ışık cevaplarından sorumlu olan bu gizemli pigmente ithafen ortaya çıktı. Şimdi biliniyor ki, bitkiler kritokrom: fototropin, FKF1, ve Arabidopsis thaliana türünün HY4 geni tarafından kodlanmış fotoliyaz DNA’sına yüksek benzerlik gösteren bu proteinin orijinal tanımına uygun olarak en az 3 çeşit flavoprotein içeriyor .
HY4 geni tarafından kodlanan mavi ışık fotoreseptörü bitkilerdeki ilk mavi ışık fotoreseptörü olarak kabul edildi ve bundan dolayı kriptokromun anlaşılmaz olduğu varsayıldı ve bu şekilde yeniden adlandırılmış oldu.
Memeli Kriptokromları: Memeli Kriptokromlarının Keşfi
Ayrıntılı biyokimyasal verilere dayanarak, insanlarda ve diğer plasentalı memelilerde fotoliyaz yoktur sonucuna varılmaktadır. Bu yüzden, 1995’teki insan genomu verilerine dayalı ifade edilmiş tag sekansı olarak fotoliyaz orthologunun raporu beklenmemişti ve önceki sonucun yeniden değerlendirilmesine yol açtı. Hsu et al. ne bu proteini ne de ikinci bir orthologu buldu, sonrasında fotoliyaz aktivitesine sahip olduğunu keşfetti ve bu proteinlerin insan hücrelerindeki diğer mavi ışık-bağımlı fonksiyonlarda performans gösterdiğini önerdi ve human cryptochrome 1, human cryptochrome 2 (hCRY1 ve hCRY2) olarak isimlendirdi.
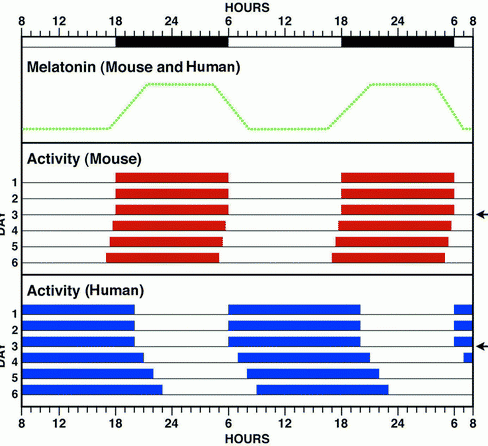
Sirkadyen fotoreseptörleri olarak kriptokrom fonksiyonu hipotezini test etmek için Cry1 ve Cry2 yollarının ifadesi analiz edildi. Kriptokromların tüm dokularda ifade edildiği bulundu fakat yine de; ifade, insanda ve farede retinada ve iç retinayla sınırlı kısımlarda yüksek seviyedeydi. Beyinde, mCry1 SCN’de yüksek oranda ifade ediliyordu ve ifade, 2.00 p.m. civarında tepe noktasına ve 2.00 a.m. civarında en düşük seviyede seyreden günlük salınım sergiliyordu. Böylece, kriptokrom saati kurmak ve çalıştırmak için uygun olan yerlerde ifade edildi ve sadece, “kriptokrom bir sirkadyen ritim fotoreseptörüdür “hipotezi olmadığına dair güven vermekle kalmadı kriptokromun bir moleküler saat bileşeni olma olasılığını da arttırdı.
Sonrasında, kriptokromlar Drosophila’da bulundu ve Xenopus’da olduğu gibi diğer tüm böceklerde ve genomu sekanslanmış olan diğer tüm omurgalı hayvanlarda test edildi.
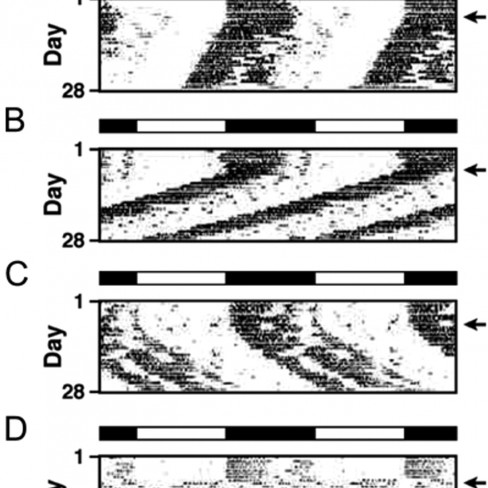
Farelerle tekerlek döndürme aktivitesi yapılmıştır. Y ekseni boyunca gösterilen tekerleğin hızı (rpm), X ekseni boyunca gösterilen ise günün belirli zamanlarını göstermektedir. En üstte yer alan bar günün karanlık ve aydınlık dönemlerini belirtmektedir. Bu grafik farelerin 28 günlük aktivitesini göstermektedir. Oklarla belirtilen günlerde fareler 12 saat karanlık, 12 saat aydınlık döngüsünden sabit karanlık evresine alınmıştır. A, wild type, τ = 23.7 h; B, Cry1–/–, τ = 22.7 h; C, Cry2–/–; τ = 24.7 h; D, Cry1–/–;Cry2–/–, arrhythmic.)

California Eyaleti, San Diego, Salk Institute Regulatory Biology Laboratory’den Doç. Dr. Satchin Panda ve ekibi her sabah çalar saat olmasa bile bizi aynı saatte uyandıran ve biyolojik saatin bir bileşeni olan geni ve mekanizmasını keşfetti. Bu keşif, uykusuzluk, yaşlanma ve kanser, diyabet gibi kronik hastalıkların genetik temellerini açıklamaya yardımcı olabilir.
Doç. Dr. Satchin Panda, “Geceleri saatimize yavaşlamasını söyleyen mekanizmayı kabaca biliyorduk, fakat sabahları bizi tekrar neyin aktifleştirdiğini bilmiyorduk. Onu henüz keşfettik , artık biyolojik saatin işlev bozukluklarının (malfunction) bizi nasıl yaşlandırdığını ve kronik hastalıklar geliştirdiğini daha derin bir şekilde araştırabiliriz.” diyor.
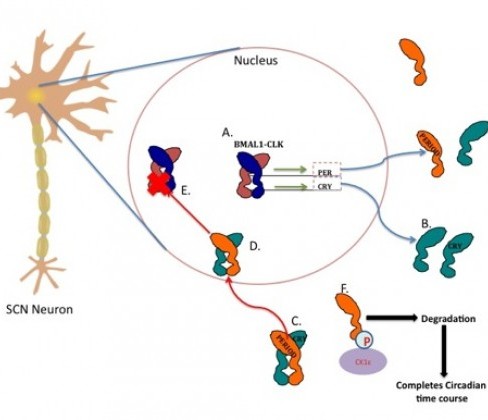
Hayvanlardaki sirkadyen osilatörleri, CLOCK veBMAL transkripsiyon faktörlerinin etrafında dönen transkripsiyon-translasyon döngüleri temellidir. Araştırmacılar, PER2 promoterına toplanan CLOCK-BMAL1 ile kompleks oluşturan histone lysine demethylase 1a (JARID1a) içeren JumonjiC (JmjC) ve ARID domainini buldular. JARID1a histon deasetilaz 1 fonsiyonu tarafından inhibe edilmiş histon asetilasyonunu arttırır ve demethylase-independent mannerdaki CLOCK-BMAL1 tarafından transkripsiyonu arttırır. Memeli hücrelerindeki JARID1a’nın tükenmesi Per promoter histon asetilasyonunu azaltır ve sirkadyen ritim periyodunu kısaltır. Drosophila soyları JARID1a homologunun (lid) azaltılmış ifadesiyle Per ifadesini azalttı ve benzer bir şekilde sirkadyen ritmi değiştirdi. Böylece JARID1a sirkadyen osilatörlerinde dikkate değer bir role sahip oldu.
Salk araştırmacıları ve onların Mc Gill Üniversitesi’ndeki ve Albert Einstein Tıp Fakültesi’ndeki çalışma arkadaşları, KDM5A geninin, sirkadyen ritmi koruyan biyokimyasal döngüye aktive edici olarak hizmet eden JARİD1a proteinini nasıl kodladığını anlatan bir makale yayınladılar.
Bu keşif, günlük uyku-uyanıklık döngümüzü kontrol eden moleküler mekanizmadaki boşlukları doldurmaktadır. Biyolojik saatimizde merkezi rol oynayan protein PERIOD (PER) proteinidir. Her bir hücremizde bulunan PER proteini sayısı her 24 saatte artıp azalmaktadır. Hücrelerimiz PER proteini seviyesini günlük zaman dilimlerinin indikatörü olarak kullanır ve vücudumuza ne zaman uyuyup ne zaman uyanacağını söyler.
Bilim adamları, PER protein seviyesini arttırmada anahtar rol oynayan CLOCK ve BMAL1 genlerini biliyordu. PER proteini seviyesi gün boyunca yükselir, akşam tepe noktasına ulaşır, bir şekilde CLOCK ve BMAL genlerini frenler, böylece gece boyunca kendi seviyesini azaltır.
Gece düşen PER proteini seviyesi biyolojik sistemimizin yavaşlamasına sebep olur: kan basıncımız düşer, kalp atımımız yavaşlar, zihinsel süreçler askıya alınır. Fakat, şimdiye kadar, gece frenlemesinin kusursuz doğası ve CLOCK ve BMAL proteinlerinin, her sabah PER protein seviyesini tekrar yükseltmek için bu frenin üstesinden gelmelerine neyin izin verdiği bir sırdı.

Öncelikle Salk’s Innovation Fund tarafından desteklenen bu araştırmada, Panda ve çalışma arkadaşları, hücreleri ve organları her sabah tekrardan çalışmaları için uyaran JARID1a enzimini tanımladı. Araştırmacılar, insandaki, fare hücrelerindeki ve meyve sineklerindeki sirkadyen ritmin altında yatan genetik mekanizmaları çalışarak, normal döngü için hem hücresel düzeyde hem de organizmaların günlük davranış koşullarında JARID1a’nın gerektiğini keşfettiler.
JARID1a üretimi azaltılmış genetiği değiştirilmiş insan ve fare hücrelerinde, PER proteini her günkü normal tepe noktasına yükselmedi. Benzer bir şekilde genetiği değiştirilmiş meyve sinekleri de düşük PER proteini seviyesi gösterdi. Sinekler zaman kavramını kaybetti: ne zaman uyuyup ne zaman uyanacaklarını bilemediler ve gündüz ve gece boyunca sıklıkla kısa kısa uyudukları kaydedildi.
Biyolojik saatin moleküler çalışmalarında daha derine inmekte olan Panda ve çalışma arkadaşları, HDAC1 durdurucu proteininin çalışmasına karşın her sabah CLOCK ve BMAL1’i JARID1a’nın reaktive ettiğini buldular. PER proteininin HDAC1’e geceki üretimini durdurmasını söylediğinden şüphelendiler.

Araştırmacılar, saatin çalışmasıyla ilgili buluntularını desteklemek için JARID1a geni olmayan genetiği değiştirilmiş fare hücreleri ve meyve sinekleriyle çalıştılar. HDAC durdurucu geni serbestleştirilmiş sinek DNA’sına JARID1a genini eklediler, böylece sinekler normal döngülerine döndüler. Fare hücrelerini, biyolojik saatlerini normal bir şekilde düzenlemelerine izin veren JARID1a’yı taklit eden bir ilaç ile tedavi ettiler.
Şimdi bilim insanları her gün neden uyandığımızı anlıyor, uyku bozuklukları ve kronik hastalıklardaki JARID1a’nın rolünü, muhtemelen onu yeni ilaçlar için hedef olarak kullanarak, keşfedebilirler.

Yaşla birlikte, örneğin, yaşlı insanların uyumakta zorluk çekmesine sebep olan şey biyolojik saatin çöküşü olarak görülmektedir. Hemşire ve acil personeli gibi uzun vardiyalarda çalıştığı için normal 24 saatlik uyku-uyanıklık döngüsü kırılan vardiyalı çalışanların belli hastalıklarda yüksek derecede risk altında olması buna en güçlü kanıttır.
Ayrıca biyolojik saatin hastalığın gelişimi için önemli olduğu ,büyük olasılıkla metabolik döngüler üzerindeki günlük etkiye bağlı olarak, görülmektedir. Günlük hücre döngüleri, hem normal gelişimde hem de kanserde, hücrelerin nasıl gelişeceğini ve bölüneceğini kontrol eden genetik mekanizmaların normal düzenlenmesi için temeldir.
Diyabet ve diğer kronik hastalıkların hücresel mekanizmaları, biyolojik saat tarafından kontrol edilen metabolik döngülere de bağlıdır. Örneğin; günün belirli saatlerinde normal olarak olan şekerlerin yağa dönüşümü diyabetiklerin vücudunda gün boyunca yer alıyor gibi görünüyor ve saatin kontrolünü kaybettiği öne sürülüyor.
Panda, “Sağlıklı ve genç kalmak demek iyi bir gece uykusu demektir.” diyor ve ekliyor, “Şimdi, günlük döngümüzün aktivasyonundaki JARID1a’yı tanımladık ve neden bazı insanların sirkadyen ritminin çalışmadığını keşfetmek için tüm yollara sahibiz ve onlara yardım etmek için yeni yollar bulmamız olası.”
Neurospora crassa mantarında spor gelişimindeki sirkadyen ritim

Dünyadaki yaşamın en etkileyici yönlerinden biri, çoğu organizmanın gün doğumu ve batımının fırsatlarına ve zorluklarına hazırlanmalarına izin veren yüksek hassasiyette bir saat bulundurmalarıdır. İnsan biyolojisindeki saatin yaygın etkisi yüzünden, saatin bozulması ile birlikte uyku bozuklukları, bilinmeyen nedenleri olan epilepsi, serebrovasküler hastalıklar, multiple sclerosis, başağrıları, kardiyovasküler işlev bozukluğu ve kanser ortaya çıkar.
Buna ek olarak, metabolizmadaki günlük değişiklikler ve hücre bölünme hızı, kanser ilaçları da dahil bazı ilaçların yararını ve toksisitesini etkiler. Bu yüzden, bu saatlerin nasıl işlediğini ve onları moleküler seviyede neyin düzenlediğini bilmek, insan sağlığını arttıracak yeni yolların gelişimi için önemlidir.
Prof. Deborah Bell-Pedersen’in laboratuvarında, sirkadyen ritmi anlamak için modern moleküler, biyokimyasal, genetik ve genomik araçları Neurospora crassa basit model organizmasındaki ritmi regüle eden saatin mekanizmasını araştırmak için kullanılıyor. Ekibi, mantarlardaki saatin regüle ettiği ana sinyal yolunu keşfetti. Bu sinyal yolunun aynısı insanlarda da var ve stress cevaplarını, immün aktiviteyi ve kanseri kapsıyor. Bu regülasyon, saatin deregülasyonunun kansere katkıda bulunduğu gözlemlerine mantıklı bir açıklama getiriyor ve tedavi için yeni fırsatlar sunuyor.

Amerika’da Salk Institute Panda Lab’da Doç. Dr. Satchin Panda ile staj yaptığım süre boyunca bahsettiğim çalışmaları yakından takip etme ve uygulama fırsatı buldum. Bu sebeple diyebilirim ki; sirkadyen ritim vücudumuzda bulunan çok temel bir mekanizmadır ve pek çok kronik hastalığın sorumlusudur. Özellikle de yaşlanma ile ilişkisi üzerine çalışmalar oldukça güncel konulardır ve araştırılmaya devam etmektedir.
Bir gen ve enzimin keşfedildiği bu laboratuvarda daha pek çok keşfin ve tedavinin bulunacağı aşikar. Fakat ne yazık ki, ülkemizde bu konuda çok fazla çalışma mevcut değil. Umuyoruz ki, önümüzdeki yıllarda bu konunun ehemmiyeti farkedilir ve daha çok makale yazılır.
Kaynaklar:
http://www.salk.edu/news/pressrelease_details.php?press_id=521
DiTacchio L., Hiep D. Le, C. Vollmers, Hatori M., Witcher M., Secombe J., Panda S. 30 September 2011. Histone Lysine Demethylase JARID1a Activates CLOCK-BMAL1 and Influences the Circadian Clock. Science, 333: 1881-1885
http://www.scripps.edu/lamia/Lamia_website/Research.html
http://www.jbc.org/content/279/33/34079.short
Sancar A. 27 April 2004. Regulation of the Mammalian Circadian Clock by Cryptochrome. The Journal of Biological Chemistry, 279: 34079-34082
http://www.bio.tamu.edu/FACMENU/FACULTY/Bell–PedersenD.php
http://www.ks.uiuc.edu/Research/cryptochrome/